
التحليل الإحصائي في دراسات ثبات الأدوية: تقنيات قياسية ونماذج تحليلية لتحديد فترة الصلاحية
اكتشف تقنيات متقدمة لتحليل الثبات الدوائي وتحديد فترة الصلاحية لمنتجات الدواء. يتناول المقال استخدام الإحصاءات والنماذج التحليلية وفقًا لمعايير المجلس الدولي للتنسيق (ICH) لتقييم بيانات الثبات، مع توضيح الإجراءات والاختبارات المستخدمة. يُلقي المقال الضوء على أهمية دراسات الثبات في قياس تأثير الظروف البيئية على جودة المواد الدوائية، مع توجيه التحليل نحو تقدير فترة الصلاحية بشكل دقيق. تُستعرض أيضًا النماذج المحتملة لتحليل البيانات وكيف يمكن دمجها لتقدير فترة الصلاحية بشكل فعّال.

أحد الأغراض الرئيسية لاختبار الثبات الدوائي هو تحديد فترة الصلاحية لمنتجات الدواء هذه. هدف هذه المقالة هو التحليل الاحصائي لأكثر من ثلاث وجبات ثبات لتحقيق قابلية الدمج. يتم إجراء دراسات الثبات لدراسة تأثير العوامل البيئية مثل درجة الحرارة والرطوبة والتعرض للضوء على جودة المادة الدوائية أو المنتج الدوائي بمرور الوقت. تم تصميم الجدول البياني لتلبية معايير قابلية الدمج وفقًا لإرشادات المجلس الدولي للتنسيق(ICH) الثلاثي الموحد لتقييم بيانات الثبات (International Council for Harmonization Harmonized Tripartite guideline for evaluation of stability data)، Q1E. تهدف دراسات الثبات في صناعة الأدوية إلى قياس تحلل منتج الدواء مع مرور الوقت. يتم إجراء هذه الدراسات عن طريق أخذ عينات عشوائية من وجبة مخزنة تحت ظروف محددة. من خلال استخدام البيانات من هذه الدراسات، يتم حساب معدل التحلل كمعامل جودة مع مرور الوقت. تعد فترة الصلاحية هي النقطة التي يتقاطع فيها الفاصل الزمني للثقة السفلي 95% من المعادلة الخطية مع 90% من الكمية المحددة سابقاً. تظهر تقدير فترة الصلاحية لوجبة واحدة تخيلية في الشكل 1.
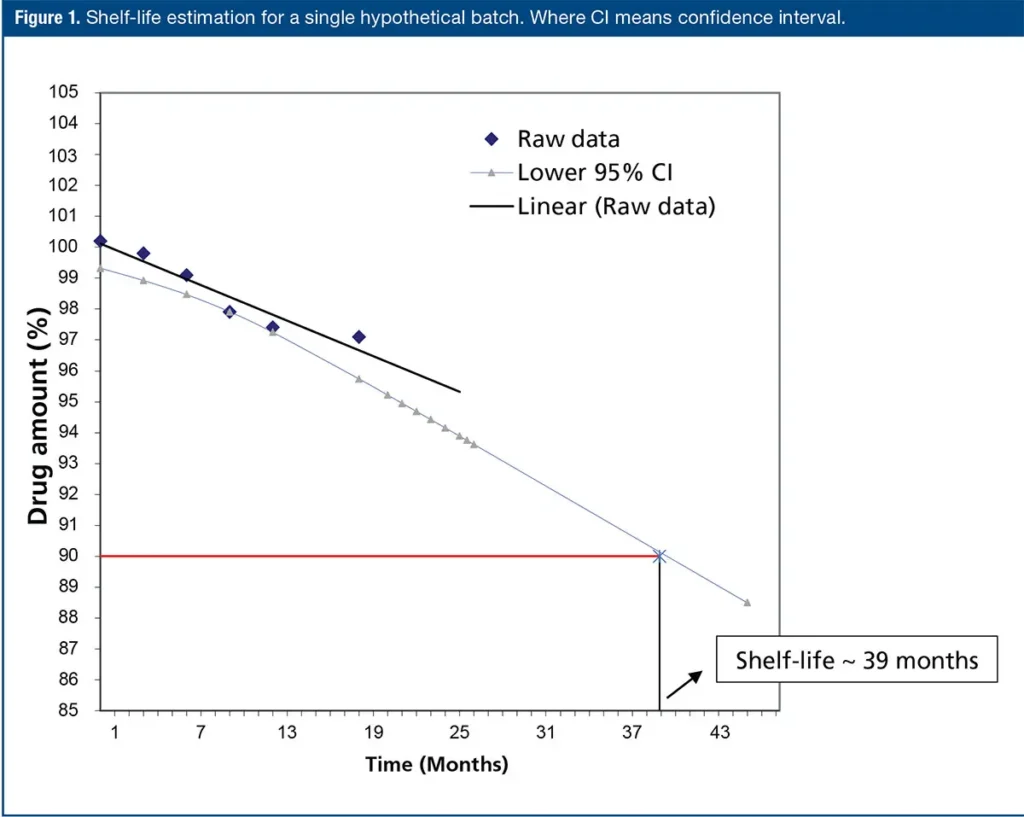
المجلس الدولي للتنسيق Q1E تقييم البيانات للاستقرار، يصف الإجراءات المتبعة لتقدير فترة الصلاحية. الهدف من التحليل الإحصائي الموضح في الدليل هو تحديد التباين بين هذه الوجبات ومن ثم تقدير فترة الصلاحية وفقًا لذلك. عند تصنيع وجبات متعددة، يمكن دمج البيانات من هذه الوجبات لحساب فترة الصلاحية. وفقًا لدليل ICH، يتم استخدام تحليل التباين (ANCOVA) لاختبار الفارق الإحصائي بين ميلين وقمتين لخطوط الانحدار المستمدة من هذه الوجبات المتعددة باستخدام الزمن كمتغير تابع. يتم استخدام مستوى دلالة يبلغ 0.25 كمعيار للدمج.
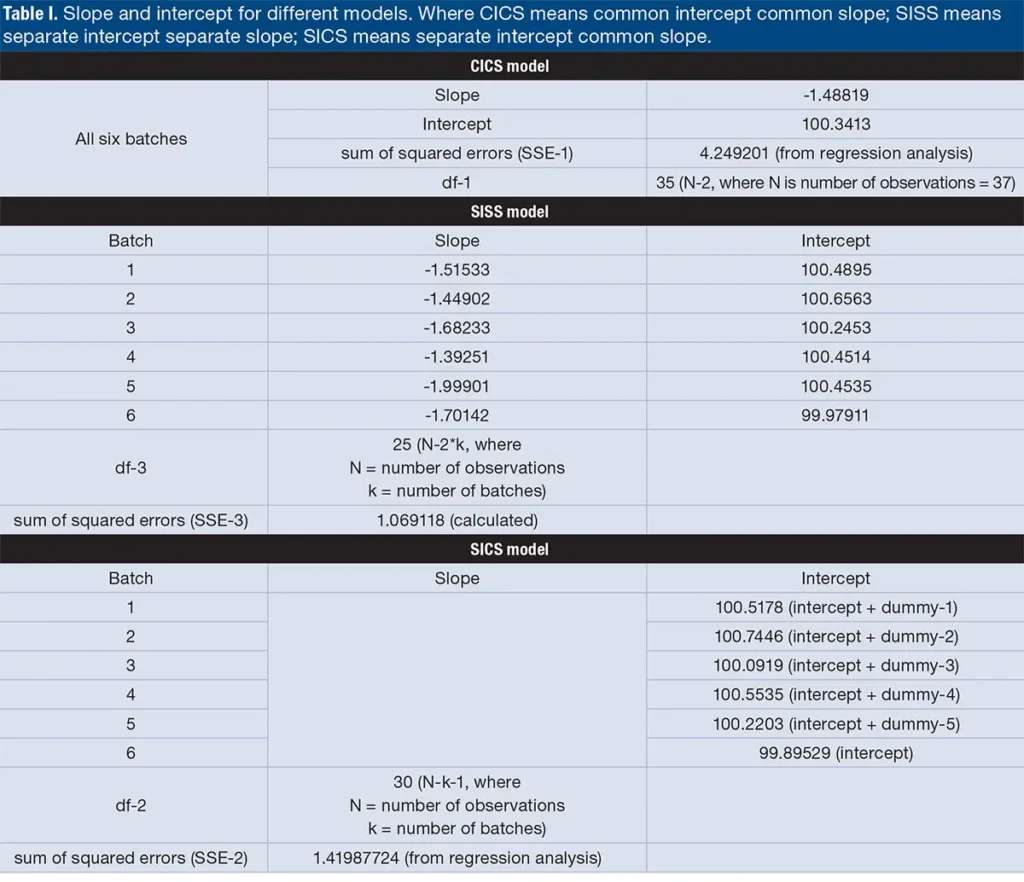
في طريقة الاختبار، تم اختبار مجموعتي بيانات للاستقرار، تحتوي كل منهما على ست وجبات من بحث Ruberg and Stegeman بشكل منفصل باستخدام النهج المذكور أعلاه. تشمل الإجراءات تحليل الانحدار لبيانات الاستقرار، ثم إنشاء جدول ANCOVA باستخدام هذه القيم. بالنسبة لبيانات الاستقرار المتعددة الوجبات، يظهر الشكل 2 السيناريوهات الممكنة لتحلل منتج الدواء. يتم استخدام نموذج القطب المشترك مع ميل منفصل (CISS- common intercept separate slope). يتم إدراج النماذج الأخرى المستخدمة لوصف دراسات الاستقرار أدناه.

نموذج التداخل المشترك والميل المشترك (CICS- Common intercept common slope). يشير هذا النموذج إلى أن جميع الوجبات لديها تداخل وميل مشترك. تم الحصول على قيم التداخل والميل المشترك لمجموعة البيانات باستخدام تحليل الانحدار
نموذج التداخل المنفصل والميل المنفصل (SISS- Separate intercept separate slope). يشير هذا النموذج إلى أن الوجبات المختلفة لديها ميل مختلف وتداخل مختلف. يمكن الحصول على هذه القيم من خلال تحليل انحدار منفصل لكل وجبة على حدة. يتم الحصول على مجموع مربعات الباقي عن طريق إضافة الفروق المربعة بين القيم المرصودة والمتوقعة. يتم حساب القيمة المتوقعة باستخدام الميل والتداخل من الدفعات الفردية.
نموذج التداخل المنفصل والميل المشترك (SICS- Separate intercept common slope). يشير هذا النموذج إلى أن الدفعات المختلفة لديها ميل مشترك وتداخل منفصل. يمكن الحصول على هذه القيم من خلال تحليل الانحدار باستخدام متغيرات تابعة وهمية تحتوي على واحد وصفر.
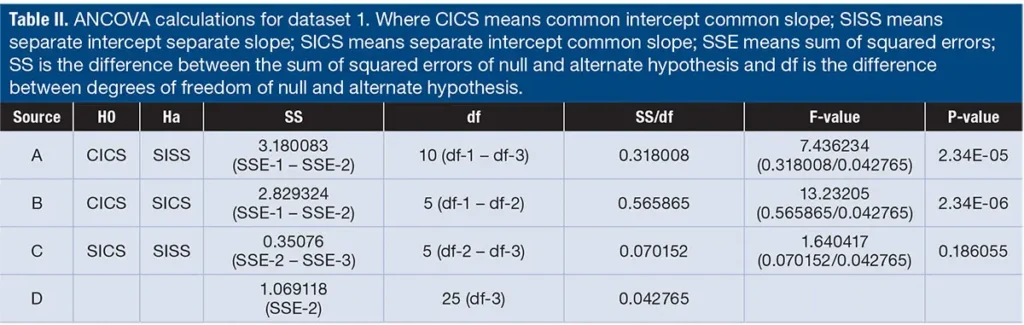
تم حساب ANCOVA لمقارنة التداخلات والميل لدفعات الثبات. تقوم هذه الاختبارات بمقارنة نموذجين، نموذج بسيط (مخفض) مقابل نموذج معقد (كامل). قيمة P التي تم الحصول عليها للصف C في جدول ANCOVA (الجدول II) أقل من 0.25، وبناءً على ذلك تم رفض فرضية الصفر (نموذج SICS) واستخدام الفرضية البديلة (نموذج SISS) لتقدير فترة الصلاحية. بالنسبة لمجموعة البيانات 2 تظهر حسابات مقارنة التداخلات والميل لدفعات الاستقرار في الجدول III. في جدول ANCOVA (الجدول IV) الذي تم الحصول عليه لمجموعة البيانات 2، كانت قيمة P للصف C أكبر من 0.25، وبالتالي فإنها فشلت في رفض فرضية الصفر (نموذج SICS). في الصف B، كانت قيمة P أقل من 0.25، وبناءً على ذلك تم رفض فرضية الصفر (نموذج CICS) واستخدام الفرضية البديلة (نموذج SICS) لتقدير فترة الصلاحية.
نموذج الثبات المختار في نهاية التحليل لكل من مجموعتي البيانات يتناسب مع النموذج المستخدم لتقدير فترة الصلاحية. ميزة هذا النهج هي إعطاء المستخدمين وسيلة سهلة ومريحة لاختبار قابلية الدمج لبيانات الثبات. لا يتضمن هذا الإجراء أي برمجة ويمكن استخدامه عندما يكون عدد الوجبات أكثر من ثلاثة. عيب في هذه الطريقة هو أنه يمكن استخدامها فقط لتقييم البيانات من عامل واحد، وهو عدد الوجبات.
المرجع المستخدم:
https://www.pharmtech.com/view/pooling-of-batches-for-stability-data-analysis