
عمليات تحقق الطرق التحليلية Analytical Validation ومعايير FDA : ضمان صلاحية النتائج الدوائية
تعرض هذه المقالة أهمية التحقق الصحيح في تحليل الدواء، حيث يتم التركيز على كيفية تأثير هذا العمل على جودة وموثوقية النتائج. يتناول المقال أمثلة واقعية لحالات التحقق الناجح والفاشل، مع التركيز على تأثير ذلك على سلامة المنتجات الدوائية. بالإضافة إلى ذلك، يتعمق المقال في معايير وإجراءات التحقق المطلوبة والمقررة من قبل إدارة الغذاء والدواء الأمريكية (FDA)، مع تسليط الضوء على أهمية الامتثال لها. تُظهر الأمثلة المُقدمة في المقال كيف يسهم التحقق الصحيح في تحسين دقة النتائج وضمان سلامة المستهلكين.
أصبح التحقق الصحيح للطرق التحليلية جزءًا أساسيًا من تطوير وتوصيف الدواء بنجاح. يتضمن التحقق من الطريقة استخدام تصميم تجريبي لإثبات أن الطريقة يمكنها إنتاج نتائج دقيقة ضمن نطاق استخدامها المقصود. فهم التطبيق والقيود المرتبطة بطريقة الاختبار سيسمح بتقييم دقيق للمعلومات العينية، بدءًا من مخرجات العمليات إلى اختبار الإصدار التجاري والعديد من الخطوات في الوسط.
الجانب الرئيسي في التحقق من الطريقة هو تحديد نطاق الطريقة التي يتم تحققها وكيف سيحدد هذا النطاق ما يجب تقييمه أثناء التحقق. هذا التحدي يظهر في بيئة التصنيع، حيث يمكن استخدام نفس الطريقة التحليلية لاختبار عينات في مجموعة من المصفوفات. في هذه الحالة، ستكون عملية التحقق من الطريقة مصممة لتوليد معلومات دقيقة حول عدة أنواع مختلفة من العينات، كل منها يتمتع بتحديات فريدة.
في بعض الحالات، لا يتم إجراء التحقق الكافي والشامل للطريقة، وهو ما يدعمه استشهادات إدارة الغذاء والدواء الأمريكية (FDA) الأخيرة بالتحقق غير الكافي للطريقة. سقطت غالبية النتائج الخاصة بالتدقيق في ثلاثة فئات رئيسية: استخدام طريقة غير مثبتة لاتخاذ قرارات حاسمة؛ التحقق الكافي الذي لم يقدم المعلومات اللازمة؛ أو التحقق من الطريقة الذي نقصته التحكمات المناسبة للحفاظ على سلامة التحقق. يُقدم فيما يلي مثال من كل فئة.
في الحالة الاولى تمت مراجعة شركة تصنيع دوائية لعدم تحقق طريقتها في جودة المنتج. وكانت السبب الذي أُعطي لعدم وجود التحقق هو تعقيد مصفوفة العينة التي تم اختبارها. في هذه الحالة، يمكن ألا يكون لدى الباحثين ثقة في البيانات المولدة، لأنه إذا كانت المصفوفة معقدة فعلاً، فقد تكون هناك قضايا غير مرئية مع دقة بيانات الاختبار. بغض النظر عن تعقيد مصفوفة العينة، يتطلب مستوى كافٍ من التحقق من الطريقة لضمان موثوقية نتائج الاختبار.
في حالة أخرى، تمت مراجعة شركة لاستخدامها طريقة غير مثبتة بشكل كاف، وأصبحت المسائل أكثر تعقيدًا. في هذه الحالة، كانت تُستخدم طريقة اختبار تركيز المنتج في العملية لتحديد الشوائب على مستوى منخفض في العينة. يمكن لطريقة اختبار العملية المثبتة بشكل صحيح تحقيق هذا النطاق، ولكن وفقًا للتحقق، لم تشمل عمليات التحقق التي تم تنفيذها اختبارات الكشف والكمية لشوائب العملية؛ لذا كانت الطريقة غير مناسبة لتحديد الشوائب على مستوى منخفض. إذا كانت هناك تركيزات متزايدة للشوائب بسبب انحراف في العملية، فقد لا تكون الطريقة المعتمدة قادرة على التحقق من الفشل. يسلط هذا المثال الضوء على أهمية التأكد من أن تحليل كامل للطريقة يتم اعتباره عند تصميم تجارب التحقق.
في الحالة الثالثة التي أُشير إليها من قبل المراجعين، تم إجراء التحقق من الطريقة، ولكن لم يتم الالتزام بالمعايير المحددة مسبقًا أو لم تكن كافية لمنع إعادة التحليل دون سبب واضح. في هذه الحالة، تمت إعادة تحليل نتائج الكروماتوغرافيا مرارًا دون استخدام آلية تحليل قياسية. أدى ذلك إلى نتائج مارست فيها البيانات التي قد تكون قد فشلت في الهدف الأصلي للتحقق.
في هذا السياق، كان عدم وجود ضوابط صحيحة والالتزام بقيود إعادة المعالجة يُنتجان في حالة يتساءل فيها عن صحة نتائج التحقق. كان بإمكان تجنب هذا إذا كان تحليل البيانات قد تم بشكل مستمر وتم تقييم النتائج بشكل نقدي. يبرز هذا المثال أهمية التحققات وفقًا لمتطلبات الممارسة الجيدة الحالية للتصنيع وأهمية بروتوكول التحقق نفسه الذي يحتوي على توجيهات حول كيفية التعامل مع فشل معايير قبول البروتوكول. في جميع الحالات المراجعة، تبين أن التحقق الصحيح المصمم لمطابقة الاستخدام المقصود للطريقة كان أمرًا حيويًا في تنفيذ اختبار تحليل دقيق وموثوق.
مراجعة تعاريف التحقق
لكي تكون مطابقة للتشريعات التي يديرها إدارة الغذاء والدواء الأمريكية (FDA)، يجب على المختبرات التي يديرها الFDA أن تقوم بتحقق إجراءاتها التحليلية. وكما هو مذكور في رموز اللوائح الفيدرالية، يجب أن تكون هناك بيانات تثبت أن الطرق المستخدمة في الاختبار تلبي معايير الدقة والموثوقية 1. اعترفت مؤتمر التنسيق الدولي (ICH) بالحاجة إلى مصطلحات وفهم عالمي للعناصر المطلوبة في المبادئ التوجيهية ICH Q2(R1)، “تحقق الإجراءات التحليلية: النص والمنهج.” 2 في وثيقة ICH، تم تعريف عناصر التحقق المطلوبة، وتوفير توصيات، فيما يتعلق بالأنواع التالية من الإجراءات:
اختبارات التعرف
اختبارات الكمية للشوائب
اختبارات الحدود للتحكم في الشوائب
اختبارات التحليل للمكون النشط في مادة الدواء، أو منتج الدواء، أو مكونات أخرى محددة في منتج الدواء.
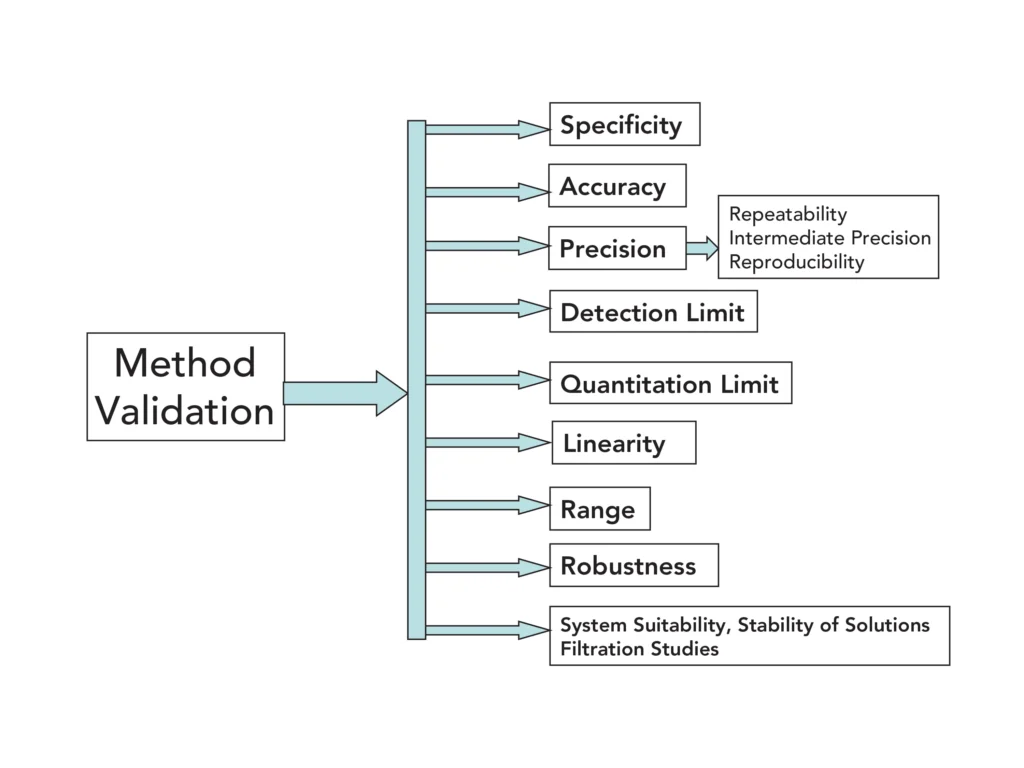
تنص وثيقة ICH Q2(R1) أيضًا على أن هذه المعلومات ليست مقصودة لتوفير توجيه حول كيفية تنفيذ التحققات، وإنما لتعزيز الفجوات التي قد تكون موجودة بين مختلف الكتب المرجعية والجهات التنظيمية في الاتحاد الأوروبي واليابان والولايات المتحدة. اعتمدت الصيدلية الأمريكية (USP)، قدر الإمكان، إرشادات ICH من Q2(R1) في فصلها العام <1225>، “تحقق الإجراءات الرسمية” 3. المعلمات التي يتطلبها ICH للتحقق هي الخصوصية، والدقة، والخطية، والدقة، ونطاق العمل، وحدة الكشف، وحدة الكمة، والقوة، وملاءمة النظام. تم تعريف كل عنصر.
الخصوصية: القدرة على تقييم المركب المحلل بوضوح في وجود مكونات قد يتوقع وجودها، ويمكن أن تشمل الشوائب ومنتجات التحلل ومكونات المصفوفة.
الدقة: تعبير عن قرب الاتفاق بين سلسلة من القياسات المتحصل عليها من عينة متجانسة متعددة الأخذ تحت الظروف المحددة. يمكن النظر في الدقة على ثلاثة مستويات: القابلية للتكرار، والدقة المتوسطة، والتكرار. تعكس القابلية للتكرار الدقة في نفس الظروف التشغيل على فترة قصيرة من الزمن، بينما تعبر الدقة المتوسطة عن التباين داخل المختبر، مثل أيام مختلفة، ومحللين مختلفين، ومعدات مختلفة، والتكرار هو مؤشر على الدقة بين المختبرات