
أثر الأنزيمات الاستقلابية على تركيب الدواء: الآليات والتأثيرات على تفاعلات الدواء والعلاج السريري
استكشف التأثيرات المعقدة لتثبيط وتحفيز إنزيمات سايتوكروم P450 وتأثيره على تفاعلات الدواء والعلاج السريري. تشمل المقالة شرح مفصل لآليات التثبيط والتحفيز من خلال دراسات على الإنزيمات المعزولة واليات العزل النسيجية. تسلط المقالة الضوء على تأثيرات التحفيز والتثبيط على استقلاب الدواء وتفاعلات الأدوية مع بعضها البعض. بالإضافة إلى ذلك، يطرح المقال السؤال “كيف يؤثر ذلك على جرعات الأدوية وفعاليتها العلاجية؟” وشرح التداخلات الدوائية وتحسين إدارة الدواء في العمل السريري.
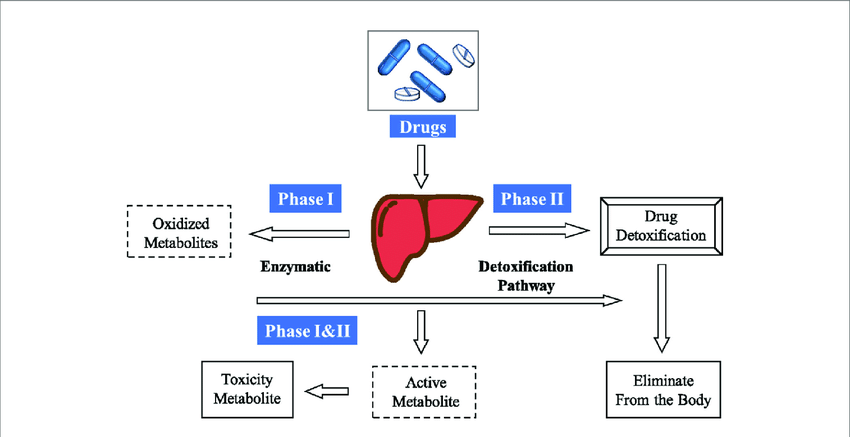
يعتبر استهلاك الدواء داخل الجسم عملية حيوية معقدة تشمل الامتصاص والتوزيع والاستقلاب والإخراج، وتُعرف هذه العمليات بمصطلح ADME (Absorption, Distribution, Metabolism, and Excretion). يُعد فهم هذه العمليات ضروريًا لتصميم الدواء بشكل فعال وتحسين فعاليته السريرية. فهي عملية معقدة تشمل العديد من العناصر مثل النواقل (Pgp) والإنزيمات الاستقلابية (CYP P450)، التي تلعب دوراً بيولوجياً على التأثيرات الدوائية (التآزر والتنافر) والتأثيرات السمية، ويمكن أن تلعب دورا كبيرا في تركيب الدواء للعثور على جزيئات دوائية أفضل والحصول على فعالية مثلى للدواء. يعتبر تمثيل(استقلاب) الدواء في الجسم عملية حيوية معقدة حيث يتم تعديل هيكل الدواء إلى جزيئات مختلفة عن طريق مجموعة من الإنزيمات الاستقلابية. تعد الدراسات حول استقلاب الدواء مهمة لتحسين المركبات الرئيسية لتحقيق الخصائص الصيدلانية والسريرية المثلى وللعثور على جزيئات كيميائية جديدة.
يحدث استقلاب المادة الدوائية في العديد من المواقع في الجسم، حيث يعد الكبد الموقع الرئيسي لاستقلاب إنزيم سايتوكروم P450 (CYP)، وهناك مواقع أخرى مثل جدار الأمعاء والرئتين والكليتين والبلازما. عملية إخراج (طرح) مواد xenobiotics (العقاقير أو المواد الكيميائية الأجنبية) تحدث في الكبد عن طريق تحويل مركبات قابلة للذوبان في الدهون إلى مركبات أكثر قابلية للذوبان في الماء إنزيميًا. مصطلح “المواد الغريبة الحيوية-زينوبايوتيك” يستخدم لوصف المواد الكيميائية الغريبة عن الحياة الحيوانية، وبالتالي يشمل أمثلة مثل مكونات النباتات والأدوية والمبيدات ومستحضرات التجميل والنكهات والعطور ومضافات الطعام والمواد الكيميائية الصناعية والملوثات البيئية.
تخضع المواد الصيدلانية لعمليات استقلاب من قبل مجموعة متنوعة من إنزيمات سايتوكروم P450 (CYPs) الموزعة على نطاق واسع في الجسم. تتألف CYPs من العديد من الايزوزيمات التي تلعب أدوارًا أيضية متنوعة وتحديدات فرعية، وكل منها له تأثير مميز على معدل الامتصاص والتوافر الحيوي للأدوية الصيدلانية في الجسم. المنتجات التي تعدل استقلاب الدواء الذي يعتمد على إنزيم P450، خاصة تلك التي لا يمكن تعديلها بشكل كبير، يمكن أن تكون لها تأثير كبير ومتسارع على الصحة.
إن أنزيمات سايتوكروم P450 (CYP) هي هيموبروتينات مرتبطة بالغشاء داخل الخلية، ويعتبر التحفيز أو التثبيط لأنزيمات سايتوكروم P450 آلية رئيسية تكمن وراء تفاعلات الدواء مع الدواء. يمكن تنشيط أنزيمات CYP بشكل نسقي عن طريق مجموعة متنوعة من المواد الكيميائية الزينوبيوتيكية والمركبات الفسيولوجية الداخلية من خلال آليات تعتمد على المستقبلات. يعتبر تثبيط أنزيمات CYP بواسطة العديد من الأدوية آلية رئيسية لتفاعلات الدواء مع الدواء القائمة على عملية الاستقلاب. العديد من الأدوية الكيميائية العلاجية يمكن أن تسبب تفاعلات الدواء مع الدواء بسبب قدرتها على إما تثبيط أو تحفيز نظام أنزيم CYP.
أنواع تثبيط الإنزيم
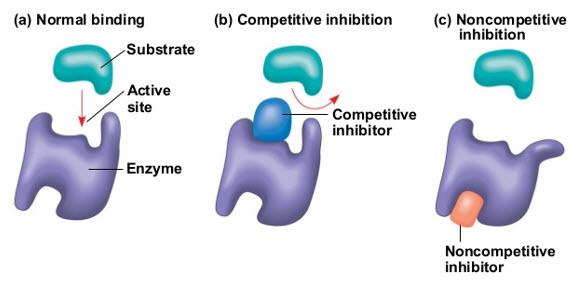
الإنزيمات هي بروتينات تساعد في تسريع عملية الاستقلاب أو التفاعلات الكيميائية في أجسامنا. الإنزيمات ضرورية للهضم ووظائف الكبد وغيرها، والجسم ينتج الإنزيمات بشكل طبيعي. ولكن تتواجد الانزيمات في المنتجات المصنعة والطعام. يتم تحديد اختصاص الإنزيم بواسطة الموقع النشط، وهو نطاق معين من جزيء الببتيد. هناك نوعان رئيسيان من النظريات التي تحاول تفسير تفاعل الإنزيم مع الركيزة. النظرية الأولى، التي اقترحها فيشر في بداية القرن العشرين، تقول إن تفاعل الركيزة مع الإنزيم يشبه آلية القفل والمفتاح، حيث يتناسب المفتاح (الركيزة) مع القفل (الموقع النشط)، شريطة أن يتحقق شرطين: أن تكون هياكل الركيزة والموقع النشط متكاملة وأن تكون قطبية وحجمها متوافق. النظرية الأخرى، التي اقترحها كوشلاند في عام 1960، تقول إن الركائز تقترب من جزيء الإنزيم وتؤدي إلى تعديلات هيكلية تخلق تناسباً بين شكل الركيزة والإنزيم.
هناك نوعان رئيسيان من التثبيط: 1. قابل للعكس 2. غير قابل للعكس (أو نصف عكوس)، ونوع آخر هو النوع المختلط. تعتبر مثبطات الإنزيم جزيئات تحتوي على فجوة (موقع نشط) يمكن أن يتم فيها تحويل (مادة الركيزة) إلى مركب آخر(منتج) ، والتي يمكن أن ترتبط بالإنزيم وتقلل من نشاطه.
1. التثبيط القابل للعكس يحدث نتيجة للتنافس على الموقع النشط للإنزيم ويشمل بشكل إيجابي تقريبًا الخطوة الأولى فقط من دورة التفاعل المحفز لـ P450. يحدث ربط المثبط بالإنزيم عادةً بروابط ضعيفة، يتم تكوينها وتفكيكها بسهولة. وبالتالي، تعمل المثبطات العكوسة بسرعة، ولكنها لا تدمر الإنزيم بشكل دائم. يحدث التثبيط التنافسي، وهو التنافس بين المادة والمثبط للربط بنفس الموقع النشط للإنزيم.
2. في وضع التثبيط غير التنافسي، يكون موقع الربط النشط للمادة والمثبط مختلفين عن بعضهما البعض، يُراقب التثبيط المختلط الذي يظهر عناصر التثبيط التنافسي وغير التنافسي بشكل متكرر.
تثبيط وتحفيز سايتوكروم P450
التحفيز والتثبيط هما آليات أساسية لإنزيمات سايتوكروم P450 (CYP)، واساسيتين لتفاعلات الدواء مع الدواء، مثل التثبيط القائم على الآلية. يشمل كل نوع من التفاعلات استراتيجية إدارة سريرية متميزة. تم توضيح خصائص وعوامل التنظيم لمختلف إنزيمات CYP إلى حد كبير اليوم. تم كشف آليات التثبيط بشكل مفصل من خلال الدراسات على الإنزيمات المعزولة أو المعبر عنها وكذلك اليات العزل النسيجية. تم توضيح النوى كمستقبلات هامة لعوامل التنظيم الكيميائية وكمنظمين للتحفيز الذي يستشعر المركبات الغريبة الحيوية الزينوبيوتيكية.
يؤدي تكرار إعطاء بعض الأدوية إلى زيادة التخليق أو التحفيز لإنزيمات P450. يزيد التحفيز من استقلاب جميع الأدوية التي تتم معالجتها بواسطة نفس إنزيم P450. لذلك، عند إعطاء عدة أدوية، يمكن حدوث تفاعلات دوائية على مستوى استقلاب P450. وهذه هي الآلية الرئيسية لتفاعلات الدواء مع الدواء. على سبيل المثال، يؤدي دواء مضاد الصرع الفينيتوين إلى تحفيز إنزيم P450 الفرعي 1A2. ويتم استقلاب الدواء المضاد للاكتئاب هالوبريدول بواسطة نفس الإنزيم. إذا أُعطي الهالوبريدول مع الفينيتوين، سيحدث استقلاب الهالوبريدول بسرعة أكبر من الطبيعي نتيجة لتحفيز الإنزيم، وسيكون التأثير الدوائي أقل فعالية. في هذه الحالة، قد يحتاج الممارسون إلى وصف جرعات أكبر من الهالوبريدول لتحقيق التأثير العلاجي المرغوب. يُستخدم الهالوبريدول بشكل شائع في علاج المرضى الذين يعانون من الفصام الحاد والمزمن. الإنزيمات المشاركة في تحول الهالوبريدول تشمل سايتوكروم P450 (CYP) ومخفض الكربونيل وتشكل نسبة كبيرة من التخلص الكبدي الحقيقي للهالوبريدول من خلال عملية الاقتراني الغلوكوروني، يليها اختزال الهالوبريدول إلى الهالوبريدول المختزل والأكسدة التي تتم عن طريق CYP
تعمل بعض الأدوية على حجب أو تثبيط إنزيمات CYP التي تستقلب أدوية أخرى. مثال على ذلك هو مثبط مستقبل الهستامين H2 المستخدم لعلاج ارتجاع المعدة، وهو مثبط لإنزيم P450 الفرعي 2C9 ، حيث يقلل من استقلاب الدواء ويزيد من فرص زيادة سمية الدواء الآخر إذا أُعطي مع المثبط. نظرًا لأن الديازيبام (دواء مضاد للقلق) يتم استقلابه بواسطة نفس إنزيم CYP450، عند إعطاء المثبط مع الديازيبام، لن يتم استقلاب الديازيبام بسرعة كالمعتاد وقد يتراكم في الجسم، مما يزيد من فرص سميته. لذا قد يحتاج الاطباء إلى وصف جرعات أكبر من الديازيبام لتحقيق التأثير العلاجي المرغوب.
يقلل كيميتيدين (مثبط إنزيم CYP2C9 P450) من عملية التمثيل الغذائي ويزيد من فرص زيادة التسمم عند تناوله مع دواء آخر. نظرًا لأن الديازيبام يتم تمثيله بواسطة نفس إنزيم CYP450، عند تناول كيميتيدين في نفس الوقت، لن يتم تمثيل الديازيبام بشكل سريع كالمعتاد وقد يتراكم في الجسم، مما يزيد من فرص التسمم.
تُستخدم وسائل منع الحمل الهرمونية، بالإضافة إلى استخدام وسائل منع الحمل الفموية (OCs)، على نطاق واسع في العديد من النساء اللواتي يعانين من الصرع – حيث لا توجد أدلة قوية على تفاقم النوبات الصرعية مع استخدامها. تعتبر الأدوية المضادة للصرع (AEDs) الأساس في التحكم في النوبات لدى النساء اللواتي يعانين من الصرع. ومن ناحية أخرى، هناك العديد من العوامل التي يجب مراعاتها في اختيار علاج AED ووسائل منع الحمل الهرمونية، حيث يمكن لبعض AEDs تقليل فعالية OCs بسبب التفاعلات الدوائية الصيدلانية. يتم تمثيل الإستروجينات والبروجستينات بواسطة سيتوكروم P450 3A4. تحفز بعض AEDs مثل الفينيتوين والفينوباربيتال والكاربامازيبين والفيلبامات والتوبيرامات والأوكسكاربازيبين والبريميدون سيتوكروم P450 3A4، مما يؤدي إلى تحسين استقلاب إما المكون الإستروجيني أو البروجستوجيني للدواء، مما يقلل من فعاليتها في منع الحمل. قد تقلل وسائل منع الحمل الفموية أيضًا من تراكمات بعض AEDs مثل اللاموتريجين، وبالتالي، تزيد من خطر النوبات. يمكن أن يساعد زيادة الوعي بتفاعلات AED في تحسين علاج النوبات لدى النساء اللواتي يعانين من الصرع.
الكاربامازيبين هو دواء مضاد للتشنج يستخدم أساسًا في علاج الصرع والألم العصبي. يحفز الكاربامازيبين استقلابه الخاص عن طريق CYP3A4، مما يعني أن جرعة الدواء تزيد كلما تم إعطاء الدواء، كلما تم تمثيله بشكل أسرع.
الريفامبيسين والأيزونيازيد هما الأدوية الرئيسية المستخدمة في علاج السل، في حين أن الريفامبيسين فعّالة للغاية في تحفيز إنزيم P450 الكبدي، الذي يلعب دوراً في عملية الاستقلاب الدوائي. عند تحقيق تحفيز الإنزيم، قد ينخفض تأثير الدواء الناتج، حيث يتم تسريع عملية الاستقلاب للريفامبيسين وللدواء الآخر.حيث يمكن أن تؤدي زيادة تراكم الدوائين المشتركين في الدم إلى حدوث تأثيرات جانبية نتيجة فقدان تحفيز الإنزيم عند التوقف عن استخدام الريفامبيسين. أما بالنسبة لمثبطات قنوات الكالسيوم من النوع 1,4-ديهيدروبيريدين مثل النيفيديبين، قد يحدث تفاعل مع الريفامبيسين، نظراً لأن معظم هذه الأدوية تتحلل بواسطة إنزيم CYP3A4.
في عام 1989، تم الإبلاغ عن تفاعل بين عصير الجريب فروت وحاصرات قنوات الكالسيوم(calcium channel blockers) فيلوديبين، حيث أدى ذلك إلى زيادة كبيرة في تراكيز فيلوديبين في المصل، فضلاً عن تعزيز تأثيرات الدواء بشكل فعّال. يحتوي الجريب فروت على الفلافونويدات (مثل الكيرسيتين والنارينجينين والكامفيرو) حيث تصل إلى 10% من الوزن الجاف. يعتقد أن نارينجين يثبط بشكل رئيسي الإنزيم (CYP3A) الذي يستقلب الحاصرات. وقد تم الإبلاغ عن تفاعلات بين البنزوديازيبينات (على سبيل المثال، الميدازولام، التريازولام)، مضادات الهيستامين (على سبيل المثال، تيرفينادين)، والأدوية المثبطة للجهاز المناعي (على سبيل المثال، سيكلوسبورين) وعصير الجريب فروت.
تشكل الأدوية القلبية أكثر من 50% من الأدوية المعروفة حتى الآن (والتي تقترب من 40 أو أكثر) التي تتفاعل مع عصير الجريب فروت. تشمل حاصرات قنوات الكالسيوم التي تم اكتشاف تفاعلها مع عصير الجريب فروت النيفيديبين، فيراباميل، ديلتيازيم، نيسولديبين، نيملوديبين، نيترينديبين، أملوديبين، ونيفيديبين. الجسيمات الكيميائية الفعّالة (الفورانوكومارين: بيرغاموتين و6′-، 7′-ديهيدروكسي بيرغاموتين) الموجودة في عصير الجريب فروت تثبط بشكل كبير نشاط الإنزيم CYP3A4 في الأمعاء مما يؤدي إلى تحلل الإنزيم وتقليل مستوياته بنسبة تصل إلى 47% خلال أربع ساعات بعد تناول عصير الجريب فروت، ويظهر أن التفاعل يقارن بين التوافر الحيوي عن طريق الفم لهذه الأدوية، ولا يؤثر على الأدوية التي تُعطى عبر الوريد. يشتبه الباحثون في أن السبب الرئيسي هو إنزيم CYP3A4 في الأمعاء، الذي يستقلب هذه الأدوية والعديد من الأدوية الأخرى.
بروتين P-الجليكوبروتين هو بروتين ناقل يُعرف أيضًا باسم البروتين المقاوم للعديد من الأدوية ويوجد في الحافة الشعرية لجدار الأمعاء، والذي ينقل العديد من المركبات الفعّالة لإنزيم CYP3A4، ويُعتقد أنه يتأثر أيضًا عن طريق عصير الجريب فروت. عند تثبيط هذه الأنظمة الإنزيمية، يعدل عصير الجريب فروت الديناميكيات الدوائية لمجموعة متنوعة من الأدوية، مما يؤدي إلى زيادة تراكيزها في المصل.
تتم تفاعلات الدواء التي تشمل P450 عمومًا من نوعين: تحفيز الإنزيم أو تثبيطه. الأدوية والمواد التي تشترك في هذه التفاعلات تكون عادة مشتركة في الخصائص الكيميائية، ويؤدي تثبيط الإنزيم إلى تقليل عملية التمثيل الغذائي، في حين يمكن أن يزيد تحفيزه. يمكن أن تكون التأثيرات الضارة ناتجة عن التفاعلات الدوائية بين الأدوية عندما يثبط دواء واحد عملية التمثيل الغذائي لدواء آخر، مما يزيد من تركيز الدواء إلى مستويات سامة.
المرجع المستخدم:
https://www.pharmatutor.org/articles/the-role-of-cytochrome-p450-in-drug-metabolism-a-basic-review