
جودة الرعاية الصحية والتيقظ الدوائي: تحالف لضمان سلامتنا الدوائية
اكتشف كيف يلعب التيقظ الدوائي دورًا حاسمًا في ضمان سلامة وجودة الأدوية ، وتعرّف على أهم الممارسات والأثر الإيجابي لهذا النظام على صحتك وصحة المجتمع.
في عالم مليء بالتقدمات الطبية والأدوية الجديدة، يُسهم التيقظ الدوائي في ضمان سلامتنا وصحتنا. إنه علم ونشاط يركز على الكشف والتقييم والفهم والوقاية من التأثيرات الضارة والمشاكل المتعلقة بالأدوية بعد ترخيصها للاستخدام. يُنسق النظام الأوروبي للتيقظ الدوائي بشكل فعّال من خلال الوكالة الأوروبية للأدوية (EMA)، ويُعد محورًا أساسيًا للرعاية الصحية وسلامة المرضى في الاتحاد الأوروبي.
تجدر الإشارة إلى أهمية التيقظ الدوائي في مراقبة الأدوية بعد ترخيصها للاستخدام، حيث تمر أدوية معينة بتجارب سريرية تُختار بدقة وتراقب عن كثب تحت ظروف مراقبة. وعندما يتم ترخيص الدواء للسوق، يُسمح باستخدامه على نطاق واسع ولفترات طويلة بالاشتراك مع أدوية أخرى. وبالتالي، يُمكن أن تظهر آثار جانبية جديدة أو مشاكل أخرى قد لا تكون واضحة أثناء المرحلة السابقة من التجارب السريرية.

الممارسات الهامة في مجال التيقظ الدوائي تشمل:
- تقييم فعالية تدابير تقليل المخاطر: يتعين على منتجي الأدوية والجهات الرقابية تقييم فعالية التدابير التي تُتخذ لتقليل المخاطر المحتملة للدواء.
- فعالية عمليات التيقظ الدوائي: يجب ضمان أن عمليات الرصد والتقييم تكون فعالة وموثوقة.
- عوامل تمكين التيقظ الدوائي الفعّال: تشمل ذلك تحفيز التعاون بين جميع الجهات المعنية بسلامة الأدوية.
- الأساليب التحليلية لأبحاث التأثير: يُستخدم التحليل البياني لبحث الآثار الجانبية المحتملة للأدوية وتقديم تقارير عنها.
تمتلك لجنة تقييم ومراقبة المخاطر الخاصة بالتيقظ الدوائي (PRAC) دورًا حاسمًا في هذا السياق. تتألف PRAC من خبراء في سلامة الأدوية من السلطات التنظيمية في الدول الأعضاء، بالإضافة إلى خبراء علميين وممثلين عن المرضى ومحترفي الرعاية الصحية. تقوم اللجنة بتقييم إشارات السلامة من خلال EudraVigilance، وتوصي باتخاذ إجراءات تنظيمية عند الضرورة.
للمزيد من التفاصيل، يمكن للمستخدمين الوصول إلى قاعدة بيانات الأوروبية لتقارير الاشتباه في حدوث آثار جانبية للأدوية ومعرفة العدد الإجمالي للتقارير لكل دواء مرخص مركزيًا.
إضافة إلى ذلك، تتوفر تقارير حول مواد الأدوية المستخدمة في الأدوية المرخصة وطنيًا منذ أكتوبر 2014. هذا يعزز شفافية ومعرفة الجمهور بمكونات الأدوية التي أخذت في اعتبارها في التراخيص المحلية.
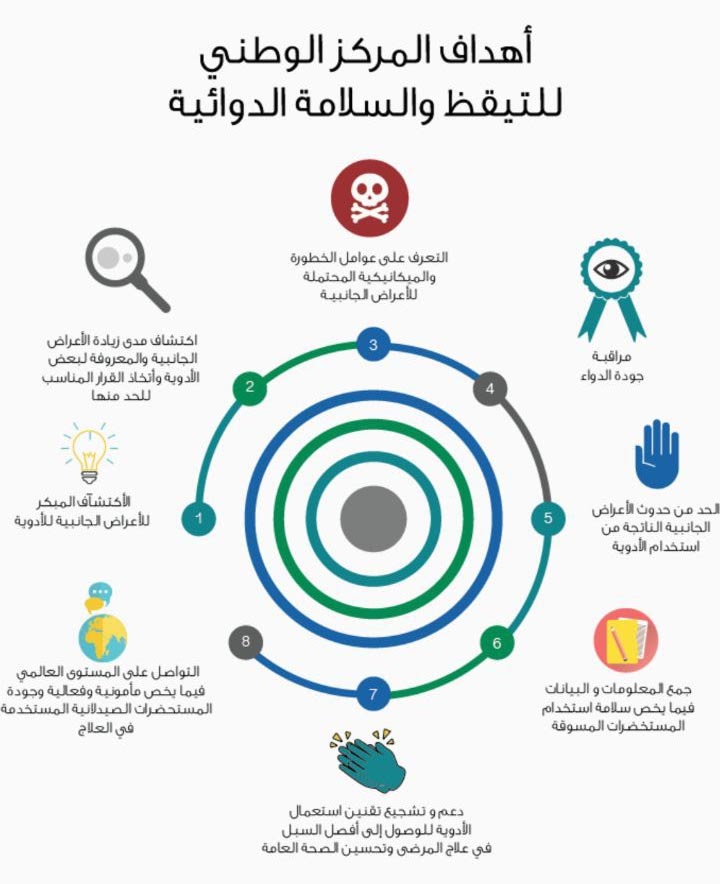
التيقظ الدوائي يشمل أيضًا استراتيجيات مهمة تساهم في مراقبة سلامة الأدوية وتقييمها بعد الترخيص. من بين تلك الاستراتيجيات:
- تحديد الأولويات وإجراء أبحاث التأثير: يعنى ذلك بتحديد الأمور التي تستدعي الاهتمام والبحث الدقيق بناءً على الأدلة المتاحة حول سلامة الدواء. هذا يمكن أن يشمل دراسات إضافية وتحليلات معمقة لفهم تأثيرات الدواء على الصحة.
- استعراض للدراسات الخاصة بسلامة الدواء بعد الترخيص: يتضمن هذا الاستعراض دراسات تمولها الصناعة لتقييم فعالية تدابير تقليل المخاطر وسلامة الدواء بعد الترخيص.
وفي إطار الإشراف على السلامة الدوائية (GVP)،تنص القوانين على أهمية تطوير نظام الجودة العام للتيقظ الدوائي. يشمل نظام الجودة الهيكل التنظيمي والمسؤوليات والإجراءات والعمليات الخاصة بنظام الرصد الدوائي، بالإضافة إلى إدارة الموارد المناسبة وإدارة الامتثال وإدارة السجلات.
أهداف الجودة العامة لنظام التيقظ الدوائي تشمل:
- الامتثال للمتطلبات القانونية المتعلقة بمهام ومسؤوليات التيقظ الدوائي.
- منع الضرر الناتج عن ردود فعل ضارة للمرضى نتيجة استخدام الأدوية، سواء داخل أو خارج شروط ترخيص التسويق أو نتيجة التعرض المهني.
- تعزيز الاستخدام الآمن والفعال للأدوية من خلال توفير معلومات موجهة في الوقت المناسب حول سلامة الأدوية للمرضى ولمحترفي الرعاية الصحية وللجمهور.
- المساهمة في حماية صحة المرضى والصحة العامة.
إن التيقظ الدوائي ليس مجرد ممارسة تنظيمية، بل هو جزء أساسي من الجهود الرامية إلى ضمان سلامة وفعالية الأدوية التي نعتمدها في حياتنا اليومية. بفضل هذا النظام، يمكن للمستهلكين ومحترفي الرعاية الصحية الاعتماد على أن الأدوية التي تصل إليهم هي آمنة وفعالة، وهذا يلعب دورًا كبيرًا في الحفاظ على سلامتنا وصحتنا.
المراجع:
Guideline on good pharmacovigilance practices (GVP)
Module I – Pharmacovigilance systems and their quality systems