عصر الطب الشخصي: كيف تعيد البيانات الضخمة تعريف الجرعة المناسبة للمريض المناسب؟
يمثل الطب الشخصي أو الطب الدقيق أحد أضخم التحولات في استراتيجيات الرعاية الصحية والقطاع الدوائي في العقد الأخير. فبعد عقود من الاعتماد على نموذج “العلاج الواحد للجميع” (One-size-fits-all)، يتجه المجتمع العلمي اليوم نحو صياغة بروتوكولات علاجية تُفصّل بناءً على الخصائص الجينية والبيئية لكل مريض على حدة، وهو ما يعد برفع نسب الشفاء وتقليل الهدر الدوائي.
ما وراء الأعراض الظاهرية
تعتمد فلسفة الطب الشخصي على فهم الاختلافات الجزيئية بين الأفراد. فالمسارات الأيضية التي تعالج الدواء تختلف من شخص لآخر بناءً على التعبير الجيني لإنزيمات الكبد . هذا التباين يفسر لماذا قد يكون دواء معين منقذاً لحياة مريض، بينما يسبب تسمماً لمريض آخر، أو لا يبدي أي فعالية لمريض ثالث. من خلال استخدام المؤشرات الحيوية (Biomarkers)، أصبح بإمكان الأطباء التنبؤ باستجابة الجسم للعقار قبل البدء في تناوله، وهو ما يغير المسار التقليدي من “التجربة والخطأ” إلى “التنبؤ المبني على البيانات”.
التكنولوجيا الحيوية والبيانات الضخمة: المحرك الصامت
لفهم تعقيد هذا المجال، يحتاج الباحثون إلى النظر في كيفية دمج علوم الأوميكس—مثل علم الجينوم، والبروتينات، والاستقلاب—مع أدوات تحليل البيانات الضخمة. إن القدرة على تسلسل الجينوم البشري بتكلفة منخفضة وفي وقت قياسي وفرت قاعدة بيانات هائلة تسمح بتحديد “الطفرات الموجهة” في أمراض مثل السرطان. على سبيل المثال، في علاج سرطان الرئة، لا يتم الاكتفاء بتشخيص نوع الورم، بل يتم البحث عن طفرات محددة لاختيار مثبطات جزيئية دقيقة تستهدف تلك الطفرة بعينها، مما يزيد من معدلات البقاء على قيد الحياة بشكل ملحوظ مقارنة بالعلاج الكيميائي التقليدي.
فعالية التكلفة وتحسين المسار السريري
أحد أهم مكاسب هذا التحول هو تحسين كفاءة التجارب السريرية. في السابق، كانت شركات الأدوية تحتاج إلى آلاف المتطوعين لإثبات فعالية دواء ما. أما الآن، فيمكن تصميم تجارب “عنقودية” تستهدف فقط المرضى الذين يمتلكون مؤشراً حيوياً معيناً. هذا لا يقلل من مدة التجربة وتكلفتها فحسب، بل يرفع من احتمالية نجاح الدواء في الحصول على الاعتمادات التنظيمية، لأن الفئة المستهدفة هي الأكثر استجابة له من الناحية البيولوجية.
بالرغم من الوعود الكبيرة، يواجه الطب الشخصي تحديات جوهرية؛ أولاً، التعقيد البيولوجي للأمراض المزمنة مثل السكري أو الضغط، حيث لا يتحكم جين واحد في المرض بل مئات العوامل المتداخلة، مما يجعل التنبؤ الدقيق أمراً بالغ الصعوبة. ثانياً، تبرز إشكالية العدالة الصحية، حيث تظل هذه الفحوصات والعلاجات الجينية باهظة الثمن، مما قد يخلق فجوة في جودة الرعاية الصحية بين المجتمعات.
البيانات الواقعية (Real-World Data)
إن القيمة الحقيقية للطب الشخصي تتبلور عندما يتم دمج البيانات الجينية مع المؤشرات الرقمية المستمدة من الأجهزة القابلة للارتداء وسجلات المرضى الإلكترونية. هذا التكامل يوفر صورة ديناميكية لصحة المريض، وليس مجرد لقطة ثابتة في زمن معين. بدأت الفرق البحثية في تطوير خوارزميات تتنبأ بـ “النكسات” الصحية قبل وقوعها، مما يحول دور الدواء من “العلاج بعد الإصابة” إلى “التدخل الوقائي الاستباقي”.
المنظور التنظيمي والمستقبلي
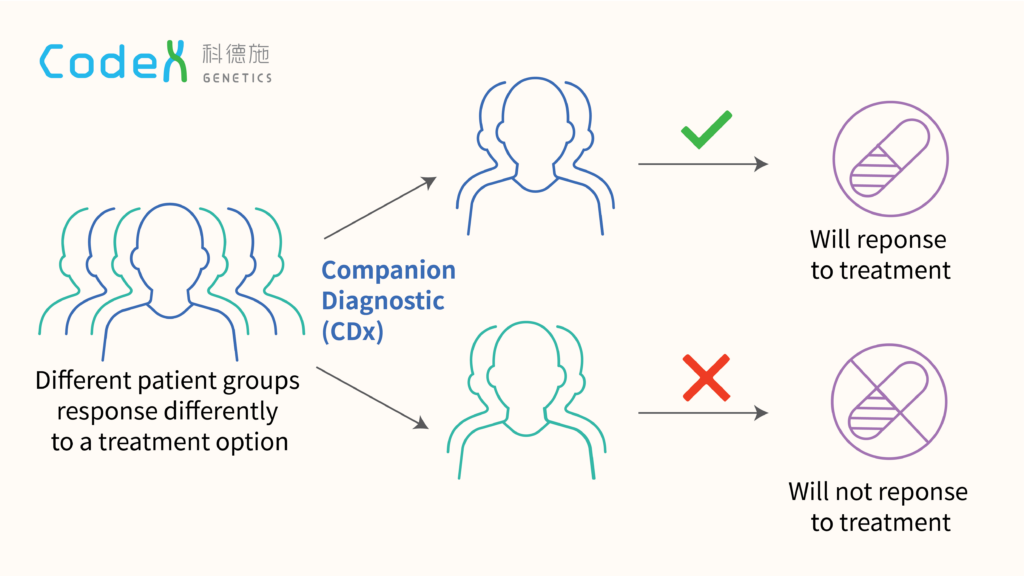
من الناحية التنظيمية، بدأت جهات مثل FDA في إصدار أدلة استرشادية خاصة للأدوية المصحوبة بـ “اختبارات تشخيصية” (Companion Diagnostics)، مما يعني أن الدواء لا يُباع إلا مع الفحص الجيني الخاص به. ومع ذلك، يبقى السؤال قائماً حول حماية خصوصية البيانات الجينية للمرضى وضمان عدم استخدامها بشكل تمييزي من قبل شركات التأمين أو أصحاب العمل.
يمثل الطب الشخصي إعادة صياغة للعلاقة بين المريض والدواء؛ حيث لم يعد الدواء مجرد مركب كيميائي، بل هو “حل ذكي” مصمم ليتوافق مع شيفرة المريض البيولوجية. ومع استمرار تطور تقنيات الذكاء الاصطناعي في تحليل هذه البيانات المعقدة، يتوقع أن نشهد طفرة في كفاءة العلاجات وتقليل الآثار الجانبية، مما يعزز من جودة حياة المرضى ويقلل من الأعباء الاقتصادية على الأنظمة الصحية العالمية.
المصادر:
The path to personalized medicine | Nature.
Biomarkers in drug development, and regulation | ScienceDirect.
The role of AI in precision medicine | The Lancet Digital Health.