التحقق من مصدوقية العمليات Process Validation :حجر اساس ممارسات التصنيع الجيدة
التحقق من مصدوقية العمليات Process Validation هو جزء أساسي من ممارسات التصنيع الجيدة (GMP) في صناعة الأدوية. منذ تقديمه الرسمي في الولايات المتحدة عام 1978، تطور التحقق من العمليات ليصبح جزءًا لا يتجزأ من ضمان أن المنتجات تفي بالمواصفات والسمات الجودة المحددة مسبقًا باستمرار. تتناول هذه المقالة التعريف الصحيح العمليات والأهداف والأنواع والتوثيق المطلوب للتحقق من العمليات، بالإضافة إلى الخطوات المتبعة لتنفيذ تحقق فعال.
الغرض من التحقق
التحقق يعرف من قبل إدارة الغذاء والدواء الأمريكية (USFDA) بأنه “تأمين دليل موثق يوفر درجة عالية من الضمان بأن عملية معينة ستنتج باستمرار منتجًا يفي بمواصفاته وسمات الجودة المحددة مسبقًا له” (CFR 21 Part 820.3(z)). الهدف الرئيسي من التحقق هو ضمان أن عملية التصنيع تنتج باستمرار منتجات تفي بمتطلبات الجودة والنقاء والفعالية. هذا الضمان يساعد المصنعين على السيطرة على العملية طوال دورة حياتها، حتى مع حدوث تغييرات في المواد والمعدات أو الإجراءات.
أنواع التحقق من العمليات
1. التحقق الاستباقي Prospective Process Validation: يتم إجراؤه قبل توزيع منتج جديد أو منتج مصنع تحت عملية تصنيع معدلة. يشمل هذا النوع بروتوكولات تحقق معتمدة مسبقًا وتأمين دليل موثق قبل تنفيذ العملية.
2. التحقق المتزامن Concurrent Validation: يتم إجراؤه أثناء الإنتاج الفعلي عندما لا يكون التحقق الاستباقي ممكنًا. يستخدم عند نقل عمليات مصادق عليها إلى مصانع تعاقدية أو مواقع تصنيع أخرى.
3. التحقق الرجعي Retrospective Validation: يستخدم البيانات التاريخية للتحقق من العمليات التي كانت قيد الاستخدام لبعض الوقت. يتضمن تحليل البيانات من الوجبات السابقة لضمان أن العملية تحت السيطرة.
4. إعادة التحقق Revalidation: ضرورية عند حدوث تغييرات كبيرة في المواد الخام او المعدات او معلمات العملية أو بيئات التصنيع. تضمن إعادة التحقق أن هذه التغييرات لا تؤثر سلبًا على جودة المنتج.
نهج التحقق ومراحله
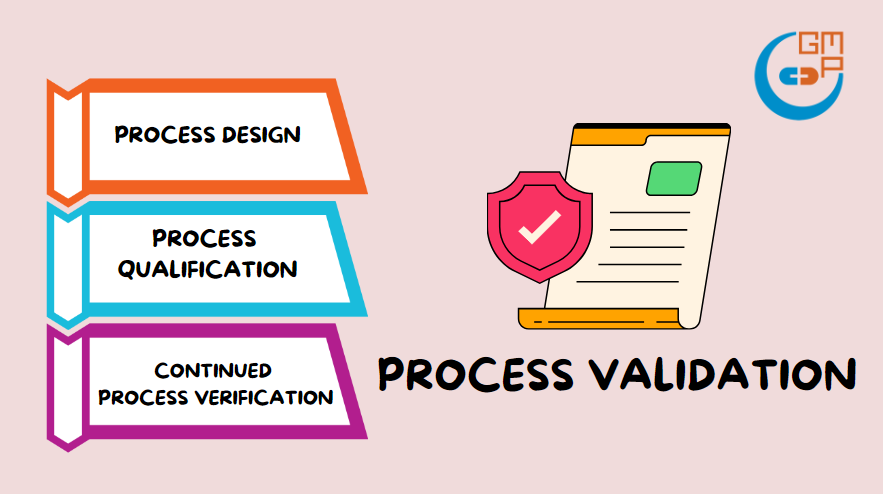
تحدد توجيهات إدارة الغذاء والدواء الأمريكية ثلاث مراحل رئيسية للتحقق من العمليات:
– المرحلة 1: تصميم العملية: تحديد عملية التصنيع بناءً على أنشطة التطوير والتوسع.
– المرحلة 2: تأهيل العملية: تقييم تصميم العملية لتحديد قدرتها على التصنيع التجاري المتكرر.
– المرحلة 3: التحقق المستمر من العملية: توفير الضمان المستمر خلال الإنتاج الروتيني بأن العملية تبقى تحت السيطرة.
التوثيق والبروتوكول
التوثيق الشامل ضروري للتحقق الناجح. ويشمل ذلك:
– بروتوكول التحقق: يصف الغرض والنطاق ونوع التحقق والمسؤوليات ومعايير اختيار الوجبات ووصف العملية والرسوم البيانية والمعدات الرئيسية ومعايير القبول. كما يحدد خطة أخذ العينات ومعلمات العملية الحرجة وسمات الجودة.
– تقرير التحقق: يلخص عملية التحقق، بما في ذلك النطاق ووصف العملية وتأهيل المعدات وجودة المواد الخام ومعلمات العملية الحرجة ونتائج الاختبار الداخلي والنهائي والانحرافات والاستنتاجات.
معلمات العملية الحرجة والضوابط
تحديد ومراقبة معلمات العملية الحرجة (مثل درجة الحرارة والوقت وpH، سرعة التحريك) ضرورية للحفاظ على جودة المنتج. يجب أن تستند هذه المعلمات إلى الدليل العلمي والبيانات من وجبات المختبرية تنفيذ الضوابط في العمليات لضمان الاتساق بين الوجبات، ويتم تحديد معايير القبول لتحديد نجاح التحقق.
إعادة التحقق
يتم إجراء إعادة التحقق في حالتين:
1. تغيير معروف: عندما تحدث تغييرات مقصودة في المواد الخام ومواد التعبئة والمعدات أو معلمات العملية.
2. إعادة التحقق الدورية: يتم إجراؤها في فترات مجدولة لضمان السيطرة المستمرة على العملية وجودة المنتج.
التحقق من العمليات Process Validation هو نشاط متعدد الوظائف يعتمد على التخطيط والتنفيذ والتوثيق. يضمن أن المنتجات الدوائية تفي بمعايير الجودة الصارمة باستمرار. تعد المراقبة المستمرة وإعادة التحقق re validation أمرًا حاسمًا للتكيف مع التغييرات والحفاظ على السيطرة على العملية بمرور الوقت.
المراجع
– ICH: GMP – Q7 (12.4, 12.5 & 12.6)
– USFDA: Process Validation – General principles and Practices (يناير 2011)
– WHO: TRS # 937-2006- Annex-4