استخدام البيانات الواقعية لتوليد الأدلة الواقعية: انعكاسات حول الدراسات غير التدخلية Non-Interventional Studies – NIS
في السنوات الأخيرة، أصبحت البيانات الواقعية (Real-World Data – RWD) والأدلة الواقعية (Real-World Evidence – RWE) عناصر حيوية في تقييم الأدوية وتنظيمها ومنها المنهجيات المتعلقة بالدراسات غير التدخلية (Non-Interventional Studies – NIS) التي تستخدم RWD لإنتاج RWE لأغراض تنظيمية.
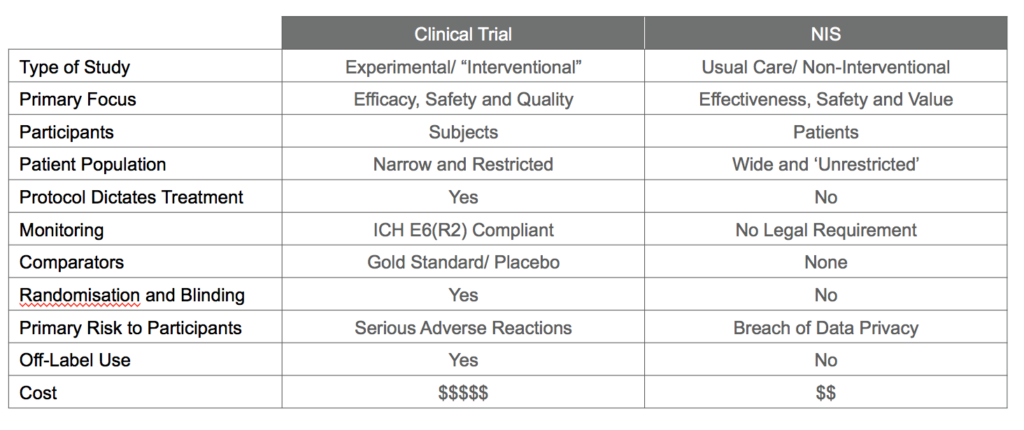
التعريفات وأهمية الدراسات غير التدخليةالدراسة غير التدخلية هي دراسة سريرية لا تفي بشروط تعريف التجربة السريرية وفقاً للمادة 2.2(2) من التنظيم (EU) رقم 536/2014. تعتمد هذه الدراسات على البيانات التي تصف خصائص المرضى وتفاصيل علاجهم ونتائجهم في الممارسات السريرية الروتينية.
تعتبر التجارب السريرية المصدر الرئيسي للأدلة لتقييم فوائد ومخاطر الأدوية أثناء إجراءات الترخيص، لكنها غالباً ما تُجرى في بيئات مُحكَمة تضمن موثوقية الأدلة. بالمقابل، توفر الدراسات غير التدخلية رؤى حول سلامة وفعالية الأدوية بعد طرحها في السوق، على الرغم من التحديات المنهجية التي تواجهها مثل عدم العشوائية وظروف العلاج غير المُحكَمة. تطور مصادر البياناتشهد العقد الماضي تقدماً هائلاً في الوصول إلى بيانات الرعاية الصحية الإلكترونية وسجلات المرضى. هذا التطور أتاح فرصاً جديدة لاستخدام RWD لتوليد RWE يعكس الممارسات السريرية الفعلية. ومن أمثلة التطبيقات الناجحة لهذه الدراسات:
– مراقبة الأدوية بعد التسويق وتقييم فعالية إجراءات الحد من المخاطر.
– وصف أنماط استخدام الأدوية وتوصيف وبائيات الأمراض.
– دعم تقييمات الجدوى وتخطيط الدراسات غير التدخلية لتقييم السلامة والفعالية بعد الترخيص.
المنهجيات المتبعة في الدراسات غير التدخليةتشمل المنهجيات الأساسية للدراسات غير التدخلية ما يلي:
التقييم الأولي للجدوى: يتضمن تقييم موثوقية وملاءمة مصادر RWD لتحقيق أهداف الدراسة.
تصميم الدراسة: يعتمد تصميم الدراسة على أهدافها المحددة سواء كانت وصفية أو سببية
تحليل البيانات: يجب أن تُجرى التحليلات الإحصائية بطريقة تراعي تحيزات الاختيار، والتباين الزمني، والتعديلات الفعالة. الالتزامات القانونية والمتطلبات التنظيمية يجب على حاملي تراخيص التسويق التعاون مع الجهات التنظيمية في المراحل المبكرة من تطوير المنتج لمناقشة ملاءمة استخدام الدراسات غير التدخلية التي تعتمد على RWD. هناك العديد من التوجيهات والإرشادات القانونية التي يجب اتباعها، بما في ذلك تنظيمات الاتحاد الأوروبي المتعلقة بالتجارب السريرية والمراقبة الدوائية. جودة البياناتجودة البيانات الواقعية أمر حيوي لنجاح الدراسات غير التدخلية. تشمل جوانب الجودة:- الموثوقية: التحقق من دقة البيانات ومصداقيتها.- الملاءمة: التأكد من أن البيانات تتناسب مع أهداف الدراسة.- الربط بين قواعد البيانات: استخدام مصادر بيانات متعددة وتعزيز ترابطها لتحسين شمولية النتائج.تعد الدراسات غير التدخلية باستخدام البيانات الواقعية أداة مهمة لتوليد الأدلة التي تدعم اتخاذ القرارات التنظيمية بشأن الأدوية. تتطلب هذه الدراسات منهجيات دقيقة وتعاونا وثيقا بين مختلف الجهات المعنية لضمان موثوقية وملاءمة الأدلة الناتجة. مع استمرار تطور تقنيات جمع البيانات وتحليلها، من المتوقع أن تلعب هذه الدراسات دوراً أكبر في تقييم الأدوية في المستقبل.