
السلفوناميد و الثاليدوميد وروفيكوكسيب : رحلة تطوير التيقظ الدوائي وعلاقتها بسلامة وصحة المرضى
اكتشف كيف تأثرت مجالات التيقظ الدوائي بالسلفوناميد والثاليدوميد وروفيكوكسيب وكيف تعزز التشريعات الفيدرالية الأمريكية سلامة المستهلك. تعرف على التحديات التي واجهت هذه المجالات والتدابير التي اتخذتها إدارة الأغذية والأدوية لضمان سلامتنا.
التيقظ الدوائي هو تخصص علمي تغير كثيرًا في السنوات الأخيرة وله أهمية اجتماعية كبيرة. حالة مستحضر السلفوناميد المعروفة أظهرت أهمية هذا التخصص. منذ ذلك الحين، تطورت المراقبة الدوائية لتصبح تخصصًا علميًا ذو طابع اجتماعي قوي. في هذه المقالة، يتم استعراض تاريخي لعدة أمثلة لهذا التخصص للتفكير فيما يمكن أن تكون عليه المراقبة الدوائية في النهاية. نستنتج أن هذا التخصص يمكن أن يكون أكثر ارتباطًا بوثائق أخرى في العلوم الاجتماعية، مما سيساعد في تعزيز بيئة اجتماعية أكثر ديمقراطية تأخذ في اعتبارها احتياجات الأفراد والمجموعات الاجتماعية.

الحالة الأولى: السلفوناميد
في عام 1932، أظهر الدكتور دوماغك (1895-1964) فعالية السلفوناميدات في علاج عدوى المكورات العقدية. وبعد ذلك، في عام 1935، تم الحصول على براءة اختراع العلامة التجارية “بروتونسيل”، مما أتاح تسويق الدواء الأول الذي يحتوي على هذا المكون النشط، مما أدى إلى إنتاج وتسويق أول دواء من السلفوناميدات. أدى التسويق الإعلامي عن فعالية السلفوناميدات الأولى إلى تأثير اجتماعي كبير. في الواقع، كان هناك عنصر وهمي أثر على الآراء الإيجابية حيال الدواء. في عام 1936، تم نشر أخبار في صحيفة نيويورك تايمز تظهر أن نجل الرئيس روزفلت، بعد دخوله إلى المستشفى بسبب عدوى شديدة لللوزتين نتيجة عدوى المكورات العقدية، تم علاجه باستخدام برونتيلين، وهو شكل من أشكال بروتونسيل. نجاح هذا الدواء أدى إلى انتشار المبيعات وإلى توليد بدائل تجارية. إحدى هذه البدائل كانت ما يسمى “مستحضر السلفانيلاميد إليكسير”. تم تطوير هذا التحضير باستخدام 72٪ غليكول ثنائي إيثيلين. المشكلة كانت في أن الشركة المنتجة (شركة ماسنجيل)، كما ذكر في تقرير لوزير الزراعة في الولايات المتحدة الأمريكية نُشر في عام 1937، لم تقم بفحص سمية المكونات وركزت على تقييم الطعم واللون. علاوة على ذلك، لم تقم الشركة بنشر معلومات حول وجود غليكول ثنائي إيثيلين في المنتج. ونتج عن ذلك وفاة ما لا يقل عن 107 شخصًا بعد تناول المنتج. وبالإضافة إلى ذلك، لم تتمكن إدارة الأغذية والأدوية (FDA) إلا من توجيه اتهامات ضئيلة لشركة ماسنجيل بمشكلة تتعلق بالتسمية غير الصحيحة للمنتج، حيث ادعي أنه إليكسير على الرغم من أنه كان يحتوي على نسبة من الكحول.
في نهاية عام 1937، تم نشر مقال في مجلة الطب البريطانية (The British Medical Journal) يعكس مشكلة السلفوناميدات. يبدأ النص بالقول: “اندلعت مؤخرًا موجة من التسمم في الولايات المتحدة بشكل مذهل ومأساوي، مما أظهر بشكل غير متوقع الأخطار التي قد تنشأ عند استخدام المركبات الكيميائية للعلاج دون إجراء اختبارات مبدئية كافية لتقييم تأثيراتها السامة المحتملة“. نتيجة لهذه المشكلة ونظرًا لعدم وجود لوائح للسيطرة على عملية الإنتاج، أصدر الكونغرس الأمريكي قانون الأغذية والأدوية ومستحضرات التجميل الفيدرالي الأمريكي، وهي مجموعة من القوانين التي منحت لإدارة الأغذية والأدوية (FDA) السلطة للمطالبة بسلامة الأطعمة والأدوية ومستحضرات التجميل. ومع ذلك، وعلى الرغم من محاولات إقامة عملية تحليل والتحقق من المنتجات الدوائية، إلا أنه لم يتم إقامة عمليات جيدة لحماية المرضى ضد التأثيرات السلبية لبعض الأدوية حتى نهاية القرن العشرين.
قانون الولايات المتحدة الفيدرالي للأغذية والأدوية ومستحضرات التجميل هو بداية لرؤية مختلفة، فضلًا عن تداخل الجوانب الاجتماعية والصناعة الدوائية. في الواقع، يُعتبر هذا التنظيم بذرة التشريع الدوائي الحالي الذي يركز على عملية وقائية تشرط تسويق المنتجات الصناعية والتي تتطلب اختبارات على سلامة المنتجات الدوائية، وكذلك تمنح إدارة الأغذية والأدوية الأمريكية (FDA) صلاحيات المراقبة بعد ترخيص المنتجات للتسويق. ومع ذلك، وعلى الرغم من تنفيذ تنظيم منح الـ FDA الأمريكية مزيدًا من السلطة، إلا أن ذلك لم يمنع وقوع أحداث مماثلة. في الواقع، في 19 مارس 1941، اكتشف جورج آدامز، رئيس محطة إدارة الأغذية والأدوية في بوسطن، أن ثلاث فتيات في منطقته دخلن في غيبوبة بعد تناول خمسة عشر غرامًا من السلفاثيازول. تسببت المشكلة في عدم جودة التصنيع وفي مراقبة الجودة المتعلقة بإنتاج الدواء. في 24 ديسمبر 1940، أكد محللون في شركة التسويق “وينثروب” أن كمية من الوجبة MP 29 من السلفاثيازول كانت ملوثة باللومينال، وهو العلامة التجارية للفينوباربيتال الذي كانوا ينتجونه. تسببت هذه المشكلة في عدم إبلاغ الشركة للـ FDA بشأن التلوث، وبالتالي لم يتم سحب الدفعة المتأثرة بشكل فعال. قال ويليام ويس، رئيس مجلس إدارة شركة ستيرلينج برودكتس في ذلك الوقت، للـ FDA إنه يعتقد أن وينثروب لم تحاول إخفاء التلوث، ولكن ذلك ربما يعود إلى اتخاذ قرارات سيئة نتيجة لتقدير خاطئ لجدية المشكلة. كان هناك حوالي 120 الف قرص من السلفاثيازول الملوث من وينثروب في الولايات المتحدة مع خطر محتمل على السكان. على الرغم من أن مأساة إليكسير السلفانيلاميد، التي كانت الحدث الذي وضع بداية قانون الأغذية والأدوية ومستحضرات التجميل لعام 1938، لا تزال محفورة في ذاكرة المجتمع الأمريكي، إلا أن وينثروب لم تُبلغ إدارة الأغذية والأدوية بشأن التلوث.
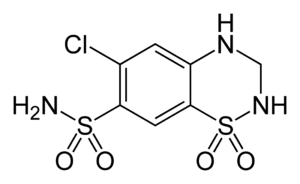
الحالة الثانية: الثاليدوميد
في عام 1954، نجحت الشركة الألمانية Chemie Grünenthal في الحصول على جزيء الألفا-فثاليميدو غلوتاريميد المعروف بالثاليدوميد.تم تصنيف هذا الدواء كمهدئ ومنوم، وتم استخدامه في عام 1957 لعلاج القلق والأرق والغثيان والقيء عند النساء الحوامل. في عام 1956، تم توثيق أول حالة منفردة من التشوهات الخلقية بعد تعرض الجنين للثاليدوميد، وخلال السنوات الخمس التالية، تم الإبلاغ تدريجيًا عن ثلاث الاف حالة من التشوهات الخلقية مثل ضمور الأذرع والأرجل وانعدام أو تقلص الإبهام أو الأصابع، وغيرها. ومع ذلك، في رسالة قصيرة إلى مجلة الطب البريطانية، أشارت فلورنس (1960) إلى أن المرضى الذين تم علاجهم بالثاليدوميد لفترات طويلة (من 8 أشهر إلى 2 سنة) أبلغوا عن آثار سلبية لاستخدام الثاليدوميد، بما في ذلك: (1) خلل في الإحساس يؤثر في القدمين ثم اليدين. (2) برودة في الأطراف واصفة بياضا ملحوظًا في الأصابع. (3) اعتلال خفيف في التنسيق. (4) تشنجات ليلية في عضلات الساق. عندما تم إيقاف العلاج وتوقف المرضى عن تناول المادة، تراجعت الآثار السلبية. وهذا دفع ليزلي فلورنس إلى الشك في سمية الثاليدوميد.في وقت لاحق، في يناير 1962، نشرت مجلة “ذي لانسيت” سلسلة من الرسائل حول آثار الثاليدوميد.وكانت أول هذه الرسائل، التي وُقعت من قبل لنز (1962)، تصف 52 طفلًا يعانون من تشوهات ناجمة عن استهلاك هذه المادة من قبل أمهاتهم أثناء الحمل. ومع ذلك، في هذه الرسالة، يذكر لنز أنهم قد ناقشوا بالفعل دور هذه المادة في تطور التشوهات البشرية في مؤتمر عُقد في 18 نوفمبر 1961.

الحالة الثالثة: روفيكوكسيب (فيوكس)
روفيكوكسيب هو دواء مضاد للالتهابات غير الستيرويدية يعمل كمثبط انتقائي لإنزيم سيكلو-أكسيجينيز وبالتالي يثبط تركيب البروستاسيلين. كان فيوكس (Vioxx) دواء تسوقه شركة ميرك شارب آند دوهم (MSD)، وكان موجهًا لعلاج أعراض التهاب المفاصل الروماتزمي والتهاب المفاصل العظمي. في الولايات المتحدة الأمريكية، اعتبرت إدارة الأغذية والأدوية (FDA) أن التقييم الفائق للمنفعة والمخاطر لهذا الدواء جيد ومنحت تصريح التسويق في 20 مايو 1999. في فبراير 2001، أعدت إدارة الأغذية والأدوية تقريرين حول مخاطر مشاكل قلبية محتملة مرتبطة بفيوكس. طلبت إدارة الأغذية والدواء من شركة ميرك فقط أن تدرج احتياطات في تسميتها التجارية. حثت المجتمع العلمي إدارة الأغذية والدواء على طلب مزيد من الاختبارات السريرية للسلامة، لكن الإدارة لم تفعل ذلك. لذلك، اعتبر المجتمع العلمي أن إجراءات الإدارة غير كافية لمنع تفاعلات الأدوية الضارة المحتملة ADRs)). في هذا السياق، تم نشر دراسات في مجلات علمية دولية رصينة حول نقائص الأساليب في الدراسات السريرية التي أُجريت على فيوكس، محذرة من ارتباطه بمخاطر قلبية خطيرة. فطلبت إدارة الأغذية والدواء من شركة ميرك فقط أن تضيف سلسلة من الاحتياطات في هذا الصدد إلى النشرة الطبية المرفقة. على الرغم من الشكوك والنقائص، حصلت شركة ميرك شارب آند دوهم في 20 يوليو 2001 على تصريح التسويق لدواء آخر يحتوي على روفيكوكسيب كمكون نشط، وهو سيوكس (Ceoxx)، الموجه لعلاج الألم الحاد للمدى القصير واضطرابات الدورة الشهرية . تم نشر مقالات تحذر من تأثيرات الأدوية الضارة المرتبطة بفيوكس من عام 2000 حتى عام 2004، وأصبحت التأثيرات الضارة الخطيرة المرتبطة بهذا الدواء واضحة بلا جدال. أبلغت ميرك إدارة الأغذية والدواء عن هذه الاكتشافات وفي 30 سبتمبر 2004، سحبت المستحضرين من الأسواق.
مراقبة الأدوية تغيرت بشكل كبير منذ قضية الثاليدوميد.تمت هذه التغييرات بشكل رئيسي في إدارة الحالات المشتبه في حدوثها (توحيد العمليات للحصول على المعلومات، واستقلال المصادر، إلخ)، وإدارة الإشارات التي تثير الشك بشأن اكتشاف ارتباط محتمل بين دواء معين وتناوله، وأخيرًا في إدارة توازن المخاطر / الفوائد لتنفيذ عمليات تقليل المخاطر للمرضى. لذلك، مراقبة الأدوية في القرن الواحد والعشرين ليست مجرد علم يكتشف ويبلغ عن الأحداث الضارة المرتبطة بالأدوية المعتمدة والمسوقة، بل هي عملية المراجعة قبل التسويق ومراقبة ما بعد التسويق، والتي تتضمن استخدام الأدوية في الممارسة اليومية.
لكل هذه الأسباب، نعتقد أنه من الضروري أن تتفاعل حقول البحث الطبي والصيدلي والاجتماعي بطريقة أكثر فعالية. وهذا سيتطلب استراتيجية مختلفة عن الاستراتيجية الحالية. في هذا السياق، يمكننا القول إن هناك عدة أطراف رئيسية متورطة: أولئك الذين يبلغون عن تفاعلات الأدوية الضارة، وأولئك الذين يبحثون في تفاعلات الأدوية الضارة، وأولئك الذين يدرسون آليات الوقاية والتعليم والإدراك الاجتماعي للأدوية من أجل فهم تفاعلات الأدوية الضارة وإذا كان ذلك ممكنًا، تقليلها. بالإضافة إلى ذلك، نعتقد أن هذا التفاعل سيسمح بتصفية المعلومات التي يتم الحصول عليها وإصدارها من قبل الصيادلة.
في النهاية، يتعين علينا الاستفادة من التجارب السابقة والعمل على تعزيز سلامة المرضى وتطوير قوانين وأنظمة تنظيمية تلبي التحديات الصحية المعاصرة. تحقيق توازن بين الابتكار الدوائي وسلامة المستهلك هو مهمتنا المشتركة لضمان تقديم أفضل الرعاية الصحية للجميع.
المراجع
https://www.frontiersin.org/articles/10.3389/fsoc.2022.974090/full