
أهمية نظام التيقظ الدوائي في مراقبة سلامة الدواء بعد التسويق ودور البيانات العالمية الحقيقية
اكتشف أهمية مراقبة سلامة الدواء بعد التسويق وكيف تسهم البيانات العالمية الحقيقية في تحسين سلامة المرضى. تعرف على أنظمة التيقظ الدوائي وتقنيات الرصد الحديثة في هذا المقال الشامل.
تُراقب سلامة الدواء باستمرار بعد الموافقة على تسويقه، في عملية مستمرة تُعرف بمجال الرصد (التيقظ) الدوائي. هذا الرصد بعد التسويق لسلامة الدواء يكتسب أهمية خاصة عندما يتعلق الأمر بالتفاعلات الضارة للدواء (ADR) التي تكون نادرة، وتحدث فقط في مجموعات معينة، أو تظهر فقط بعد تعرض طويل للدواء. في بعض الحالات، قد لا يتم التعرف على التفاعلات الضارة الخطيرة إلا بعد وقت طويل من الموافقة على تسويق الدواء، كما حدث في حالة الثاليدوميد حيث أدى استخدامه لدى النساء الحوامل إلى تشوهات خلقية. ولذلك، يتم التأكيد على أهمية مراقبة ما بعد التسويق من خلال الاكتشاف الذي يشير إلى أن ثلث مشكلات الأمان الجديدة التي تم التعرف عليها في فترة ما بعد التسويق يتم إضافتها إلى قسم التحذيرات والاحتياطات على العبوة، وهذا يشير إلى الطبيعة الخطيرة للتفاعلات الضارة الجديدة.
ماهي بيانات العالم الحقيقي Real World Data
هي البيانات التي تُجمع أثناء العناية السريرية الروتينية بشكل سجلات الصحة الإلكترونية الطبية وأنشطة جمع البيانات في عمليات اتخاذ القرارات التنظيمية والموافقة. الأدلة الحقيقية (Real World Evidence) تعني الأدلة على الفوائد المحتملة للمنتج الطبي في بيئة سريرية تم استنتاجها من RWD. النتائج المستمدة من دراسات متنوعة، سواء كانت تصميمات متوقعة أو استدراكية، والتي تستفيد من RWD وتُقبل كأدلة عالمية. إرشادات إدارة الأغذية والأدوية الأمريكية(FDA) بشأن RWE تصف العديد من الإجراءات التي يمكن استخدامها خلال دورة حياة المنتج، مثل إثبات الحاجة الطبية الغير مدروسة سابقاً في الدراسات السريرية واستخدامها كبديل لمجموعة الشاهد، ودعم توسيع التسمية، واستخدامها في إطار الدراسات ما بعد التسويق. التفويضات المتعددة لاستخدام حالات الطوارئ الممنوحة للأدوية خلال جائحة مرض فيروس كورونا 2019 تسلط الضوء على حاجة مراقبة سلامة الدواء ما بعد التسويق للمحافظة على سلامة المرضى على المدى الطويل. قد أدت التشريعات والممارسات التنظيمية إلى زيادة الاعتماد على مراقبة سلامة الدواء ما بعد التسويق لتوجيه اتخاذ القرارات التنظيمية. يتطلب الابتكار في مراقبة سلامة الدواء التعامل مع هذه التحديات وتعزيز التحسين في اكتشاف التفاعلات الضارة وتبسيط عملية تحويل البيانات في العالم الحقيقي إلى أدلة عالمية تدعم اتخاذ القرارات التنظيمية.
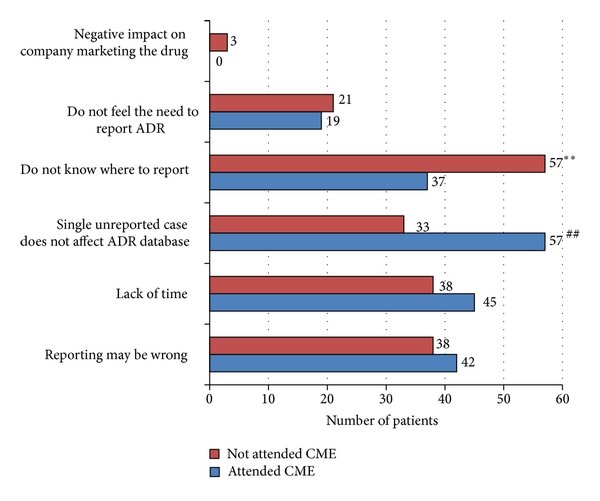
يوضح الشكل المعوقات والصعوبات التي تواجه عملية توثيق تقارير الاعراض الجانبية وذلك عند المقارنة بين مجموعتين
المجموعة الأولى (الحمراء) قام المرضى بامتناع عن التثقيف الطبي Continuing Medical Education
المجموعة الثانية (الزرقاء) قام المرضى بحضور محاضرات التعليم الطبي المستمر CME
أنظمة التيقظ الدوائي المثبتة
منذ أواخر الستينيات من القرن الماضي، تم تداول تقارير الحالات المنشورة بين الأطباء ولا تزال تلعب دورًا هامًا في مجال مراقبة الأدوية. عادةً ما تكون هذه التقارير غنية بالمعلومات لأن الأطباء مدربون على تقييم تفاصيل التاريخ الطبي وتعرض الدواء والنتائج بدقة، بالإضافة إلى أن عملية المراجعة الناقدة توفر نوعًا من مراقبة الجودة. ومع ذلك، فإن تقارير الحالات هي في الأساس بيانات تاريخية شخصية، وبالتالي لا يمكن أن تدعم استنتاجات في السكان الأوسع. تمكنت عمليات تكنولوجيا المعلومات من رقمنة وسائل الإعلام المكتوبة وظهور قواعد البيانات ومحركات البحث من جمع وتخزين واسترجاع سلس لمجموعات الحالات ذات الصلة والشاملة. ومع ذلك، تظل البيانات نصوصًا غير منظمة، والتي لا تصلح للتحليل الكمي الصارم.
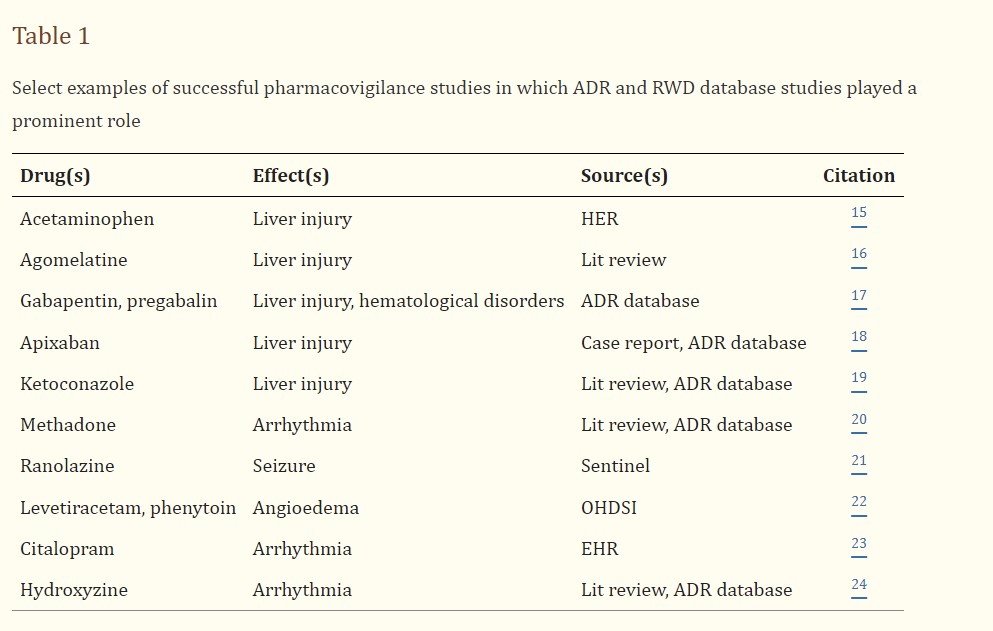
منذ عام 1993، كانت “ميدواتش” (Medwatch) وسيلة رئيسية لجمع وتحليل المعلومات حول التفاعلات الضارة للأدوية، وتُستخدم من قبل إدارة الأغذية والأدوية الأمريكية (FDA) لجمع المعلومات حول الأدوية. يتم جمع البيانات باستخدام استمارات تقارير السلامة ، التي يتم إرسالها، ورقياً أو إلكترونيًا إلى نظام الإبلاغ عن الحوادث الضارة لدى إدارة الأغذية والأدوية الأمريكية (FAERS). ثم تتم مراجعة البيانات الكلية لاكتشاف إشارات السلامة، مما يولد فرضيات للتحقيق اللاحق. نجح نظام FAERS في تحديد التفاعلات الضارة التي لم يتم الإبلاغ عنها سابقًا، حيث ساهمت بيانات FAERS في أكثر من 50٪ من جميع التغييرات في نشرات المنتجات المتعلقة بالسلامة بعد التسويق. الجدول 1 يُشير إلى مجموعة مختارة من الدراسات الأخرى في مجال مراقبة الأدوية التي لعبت FAERS أو قواعد بيانات التفاعلات الضارة الأخرى دورًا بارزًا فيها. بالإضافة إلى FAERS، لدى إدارة الأغذية والأدوية الأمريكية (FDA) أنظمة إبلاغ عن الأحداث مثل النظام الخاص بالأغذية والمكملات الغذائية ومنتجات التجميل (CAERS) وأجهزة الرعاية الطبية (MAUDE)، واللقاحات (VAERS).
ومع ذلك، تقارير حالات FAERS كمصدر للبيانات تعاني من القيود التي تتمثل في نقص البيانات والتحيز وعدم التناسق. غالبًا ما يتأثر قرارات وصف الأدوية بالعوامل التي تؤثر على النتائج السريرية مثل الأمراض المشتركة والتأمين الصحي والوصول إلى الرعاية الصحية الأولية وهي معلومات غالبًا ما تكون غير متاحة في بيانات FAERS العامة. أظهر معهد ممارسات الطب الآمن أن أكثر من نصف التقارير في FAERS كانت تفتقد معلومات أساسية، مثل العمر والجنس وتاريخ التعرض والنتيجة. بالإضافة إلى ذلك، لا تقيس FAERS إجمالي عدد التعرض في السكان، لذلك ليس هناك “قاعدة” لتقدير تكرار حالات الأحداث الضارة. على الرغم من أن الأحداث الضارة عمومًا تكون تحت التبليغ، إلا أن التبليغ المحفز الناجم عن الأخبار ووسائل التواصل الاجتماعي والإعلانات يمكن أن يزيد من معدلات التبليغ بالنسبة لبعض الأدوية. يمكن أن تكون الفرضيات الخاطئة التي تنشأ عن بيانات تقرير الأحداث الضارة الخاطئة أمرًا مكلفًا، حيث تؤدي النتائج الإيجابية الزائفة إلى إضاعة الموارد في دراسات غير ضرورية والنتائج السلبية الزائفة تؤدي إلى إلحاق الأذى بالمرضى.
اعتبارات وتحديات مستقبلية:
بعض النقاط الرئيسية التي يجب مراعاتها في المستقبل والتي يمكن تحسينها لتحسين ممارسة مراقبة الأدوية:
1. يجب أن تكون مراقبة الأدوية أقل تركيزًا على البحث عن الأضرار وأكثر تركيزًا على توسيع معرفة السلامة.
2. القرارات المعقدة المتعلقة بالمخاطر والفوائد قابلة للتحسين من خلال استخدام تحليل اتخاذ القرار.
3. يجب أن تعمل مراقبة الأدوية في ثقافة تطوير علمي. وهذا يتطلب توازنًا مناسبًا بين مساهمات مختلف التخصصات وقاعدة أكاديمية قوية، وتوفر أفضل التدريبات الأساسية، وتخصيص موارد لاستراتيجية علمية.
4. يجب تطوير وتنفيذ تدقيق منهجي لعمليات مراقبة الأدوية والنتائج استنادًا إلى معايير متفق عليها (ممارسة مراقبة الأدوية الجيدة).
بعض التحديات الرئيسية التي تواجه مراقبة الأدوية تشمل ما يلي:
- الانتشار واسع النطاق للأدوية:
توسعت عمليات توزيع الأدوية عالميًا وزاد تعرض السكان لأحجام كبيرة من الأدوية. ويشمل ذلك المستحضرات الكيميائية الجديدة المستخدمة لتخفيف الأعراض وتعديل نمط الحياة، بالإضافة إلى الأدوية المستخدمة في البلدان النامية للحد من انتشار الأمراض الوبائية مثل فيروس نقص المناعة البشري/الإيدز والملاريا والسل.
- المبيعات والمعلومات على الويب:
سهل الانترنت بيع الأدوية بدون رقابة عبر الحدود الوطنية. يتم توزيع معلومات عن الأدوية بجميع أشكالها ومع مستويات متفاوتة من الدقة عبر الإنترنت. تشمل هذه المعلومات الأدوية التي تصرف بوصفة طبية والأدوية غير المسجلة والمواد المسيطرة بشكل كبير والأدوية العشبية التقليدية.
- قضايا السلامة الموسع:
يستمر نطاق مراقبة الأدوية في التوسع مع تزايد مجموعة منتجات الأدوية. هناك إدراك أفضل بسلامة الأدوية أكثر من مراقبة وكشف وتقييم التفاعلات الضارة التي تحدث في ظروف محددة بوضوح وداخل نطاق جرعة معينة. بل هي مرتبطة ارتباطًا وثيقًا بأنماط استخدام الأدوية داخل المجتمع. المشكلات الناتجة عن استخدام الأدوية بشكل غير منطقي وزيادة الجرعات والاستخدام المتعدد للأدوية وزيادة استخدام الأدوية العشبية التقليدية مع الأدوية الأخرى، وبيع الأدوية بشكل غير قانوني ومواد سيئة الجودة وأخطاء الدواء وعدم الفعالية جميعها تندرج ضمن نطاق مراقبة الأدوية. يجب على الأنظمة الحالية التطور لمعالجة هذا النطاق الواسع بشكل كاف.
- الصحة العامة مقابل نمو الصناعة الصيدلانية:
قد تكون هناك تناقضات في صناعة الأدوية عند التعامل مع قضايا الصحة العامة الناتجة عن قضايا سلامة الأدوية. يجب على الصناعة التغلب على النقص في مراقبة السلامة خلال التجارب السريرية والمراقبة بعد التسويق.
- مراقبة المنتجات المستقرة:
لم يتعرف القطاع العام لصناعة الأدوية بشكل كامل على مسؤوليته لمراقبة سلامة منتجاته في جميع أنحاء العالم. هناك اعتقاد خاطئ بأن الأدوية الجنريكية آمنة بشكل طبيعي حتى عندما تتفاعل مع أدوية أخرى. يُعد القطاع الجنريك هو أكبر مورد للأدوية الأساسية.
المرجع المستخدم:
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8058244/